TP n° 16 : Utilisation d’un spectrophotomètre : courbes d’analyse spectrale.
Un spectrophotomètre est un appareil de laboratoire qui permet de mesurer l’intensité de la lumière transmise par une solution transparente. Il permet de tracer des courbes d’analyses spectrales utilisées pour étudier la composition de solutions, de déterminer la concentration de solutions ou de suivre l’apparition d’une espèce chimique colorée au cours du temps…
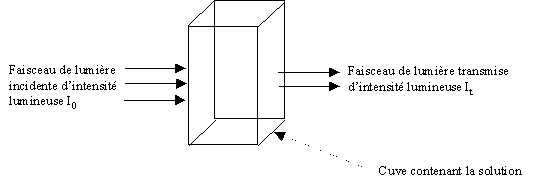
Vous étudierez la constitution d’un spectrophotomètre
lors d’un TP ultérieur. Pour mener ce TP, il vous suffit d’admettre que le
spectrophotomètre mesure l’intensité lumineuse du faisceau de lumière
incidente (I0) et celle du faisceau de lumière transmise (It)
(voir schéma ci-dessous). Le spectrophotomètre calcule alors l’absorbance
A de la solution : l’absorbance est un nombre sans unité qui dépend du
rapport ![]() et qui caractérise la solution.
et qui caractérise la solution.
Dans ce TP, vous allez étudier l’absorbance de solutions de colorants alimentaires pour des lumières de différente longueur d’onde et ainsi tracer les courbes d’analyse spectrale de ces solutions représentant l’absorbance en fonction de la longueur d’onde. Pour tracer ces courbes, vous utiliserez le tableur-grapheur Synchronie. Vous rédigerez un court compte-rendu dactylographié. Vous regrouperez l’ensemble des fichiers de ce TP (compte-rendu sur traitement de texte, tableau et graphiques) dans un dossier portant le numéro du TP.
Dans un même fichier Synchronie, vous devez tracer les courbes d’analyse spectrale :
Commenter les courbes obtenues en précisant pour chacune d’elle pour quelle(s) longueur(s) d’onde l’absorbance est-elle importante et à quelle couleur correspondent ces radiations.
Conclure sur la composition de la solution de colorant vert. Vérifier votre conclusion grâce à l’étiquette sur le flacon de ce colorant.
Exercice
Le spectre d’absorption d’une solution aqueuse de chlorure de nickel (Ni2+ + 2Cl-) est représenté ci-dessous. (figure 1)
Figure 1

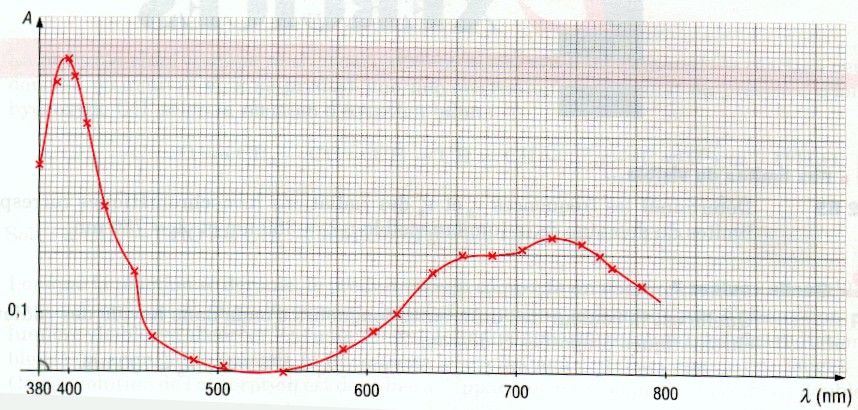
Figure 2
On a mesuré l’absorbance A d’une solution acide de dichromate de potassium (2K+ + Cr2O72-) à différentes longueurs d’onde. Les résultats obtenus sont donnés dans le tableau ci-dessous :
|
l (nm) |
380 |
390 |
40 |
410 |
420 |
430 |
440 |
450 |
460 |
470 |
|
A |
1,92 |
1,57 |
1,03 |
0,83 |
0,89 |
1,01 |
1,11 |
1,12 |
1,07 |
0,94 |
|
l (nm) |
480 |
490 |
500 |
510 |
520 |
530 |
540 |
560 |
570 |
|
|
A |
0,78 |
0,66 |
0,44 |
0,30 |
0,19 |
0,10 |
0,05 |
0,01 |
0,00 |
Claire RANDON et Tony BOIVIN
Professeurs de sciences-physiques
Lycée Augustin Thierry 41000 Blois
Webmaster :
|