C07 : TITRAGE PHMETRIQUE D’UNE SOLUTION D’ACIDE ETHANOIQUE
(ceci
est un aperçu du sujet, consulter le document Word pour avoir le document
d'origine)
Objectif : Un titrage (ou dosage) permet de déterminer la concentration molaire d’une espèce chimique présente dans une solution. Il nécessite l’emploi de deux solutions : l’une de concentration connue (solution titrante) l’autre de concentration inconnue ou à vérifier (solution à titrer).
On veut vérifier la concentration d’une solution d’acide éthanoïque CH3COOH étiquetée cA=1,0.10–2 mol.L–1. On dispose pour cela d’une solution d’hydroxyde de sodium de concentration cB=1,6.10–2 mol.L–1
- ETUDE PRELIMINAIRE
- Quelle est la base conjuguée de l’acide éthanoïque (donner sa formule chimique). Justifier
- Donner les couples mis en jeu dans le titrage puis écrire la réaction chimique observée.
- Rappeler la définition de l’équivalence lors d’un dosage.
- En déduire la relation existant entre cA, VA, cB, VBE en appelant VBE le volume de soude qu’il faudra verser pour obtenir l’équivalence. En conséquence, prévoir la valeur du volume VBE à verser si le volume d’acide à doser est égal à VA=20 mL.
- EXPERIENCE
- Introduire dans une burette graduée la solution d’hydroxyde de sodium (solution titrante).
- Introduire dans un bécher un volume VA=20,0mL de solution d´acide éthanoïque (solution dont le titre est à vérifier).
- Poser le bécher sur l´agitateur magnétique. Mettre en route.
- Etalonner le pHmètre puis la sortie analogique du capteur à l’aide de synchronie (fiche méthode n°7) en utilisant deux solutions tampon pH=7 puis pH=4 (entrer " pH-mètre initio " pour le nom du descripteur puis " pH " pour le nom)
Menu paramètres :
Entrée 0 : acquisition en mode pas à pas et instantanée, choisir le capteur pH-mètre initio, fenêtre 1 cochée
Entrée 1 : volume (en mL) en mode pas à pas au clavier, pas de fenêtre à cocher (car cette variable est en abscisse)
Onglet Fenêtres : volume en abscisse (min=0 maxi=25) et en ordonnée Min=0 et Max=12
- Faire le schéma annoté du montage.
- Lancer l’acquisition sous synchronie (touche F10) :
- faire l’acquisition du pH pour la solution acide (VB=0mL)
- Pour des volumes de soude compris entre [0mL ; VBE-2] et [VBE+2 ; 25] verser 1,0mL de soude entre chaque mesure du pH
- Pour des volumes de soude compris entre [VBE-2 ; VBE+2] verser 0,5 mL de soude entre chaque mesure..
- EXPLOITATION DES RESULTATS.
- Combien de parties peut-on y voir ? Comment peut-on expliquer la brusque variation du pH observée pour un volume de soude versé dont on donnera un ordre de grandeur ?
- Détermination géométrique du point d’équivalence E : cette détermination géométrique peut se faire de 2 façons :
- Par la " méthode des tangentes " :
construction géométrique qui doit apparaître sur la courbe. Imprimer le document puis déterminer le volume et le pH équivalent par la méthode des tangentes (ouvrir le fichier équivalence situé dans le dossier physique, document de travail et TS pour observer le principe de la méthode).- Par le tracé de la représentation de la dérivée : A l’aide de synchronie on trace la courbe
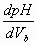
en fonction du volume VB. La valeur de VBE est l’abscisse du maximum de la dérivée. Pour cela utiliser dans le menu " Traitements ", " dérivation ", variables sources : pH, variable de destination : dpH/dV puis dérivée par rapport au volume.Trouver VBE par les deux méthodes et la valeur de cA qui en découle. Faire un calcul d’erreur.
- La transformation étudiée lors d’un dosage doit être totale, rapide et spécifique de l’espèce à titrer. Les deux derniers critères sont respectés ici. Mais la réaction est-elle totale ? Lire, sur la courbe, le pH pour un volume VB=6 mL, dressez un tableau d’avancement, calculer la quantité de matière d’ions OH- dans les états initial et final puis déterminer le taux d’avancement final. Conclure.
Matériel
Par groupe :
- solutions étalons 4 et 7
- pHmètre initio
- pipette jaugée de 20 mL
- burette graduée
- 3 pots
- bécher de 100mL
- pipette plastique
- papier joseph
- agitateur magnétique
- pissette d’eau distillée
- pince en bois pour maintenir la sonde pHmétrique
Au bureau :
- solution d’acide acétique 0,01mol/L 1L/classe
- solution de soude 0,016 mol/L(très précise) L/classe
- grand thermomètre sur support
- fils de cuivre pour déboucher les burettes
- imprimante
Retour à la page Terminale