C05 : DETERMINATION D’UN QUOTIENT DE REACTION PAR CONDUCTIMETRIE - CONSTANTE D’EQUILIBRE
(ceci
est un aperçu du sujet, consulter le document Word pour avoir le document
d'origine)
Objectifs :
- Mesurer la conductivité s d’une solution aqueuse d’un acide organique.
- En déduire les concentrations des espèces présentes dans l’état d’équilibre obtenu après réaction de cet acide avec l’eau et le quotient de réaction Qr,éq pour cet état d’équilibre.
- Etudier l’influence de l’état initial sur Qr,éq en utilisant des solutions de concentrations différentes du même acide.
- Etudier l’influence de la nature de l’acide.
On rappelle qu’un acide organique du type RCOOH réagit de façon limitée avec l’eau selon l’équation bilan :
RCOOH(aq) +H2O = RCOO–(aq) + H3O+(aq) (R désignant ici un groupement alkyle ou un noyau benzénique)
et le quotient de cette réaction pour un état du système à la date t est défini par :
- RAPPELS DE CONDUCTIMETRIE
.
- Un conductimètre mesure toujours la conductance G (en Siemens, de symbole S) de la portion de solution aqueuse ionique comprise entre les 2 plaques de sa cellule conductimétrique. La conductance dépend de la solution et des caractéristiques physiques de la cellule.
- La mesure de G permet de calculer la conductivité s (en S.m–1 ) de la solution ionique grâce à la relation :
s = k .G. k : constante de la cellule ( ) en m–1, L distance entre les plaques de la cellule en m et S, surface d’une plaque en m2
) en m–1, L distance entre les plaques de la cellule en m et S, surface d’une plaque en m2
Certains conductimètres donnent G et il faut ensuite calculer s connaissant k
D’autres, comme ceux du lycée, font le calcul et affichent directement la valeur de s .
- s est une grandeur caractéristique d’une solution ionique :
Pour une température donnée, elle dépend de la concentration des différents ions Xi qui la constituent et de leur conductivité molaire ionique l i selon la formule :
 s en S.m–1 , l i en S.m2.mol–1. et [Xi] en mol.m–3
s en S.m–1 , l i en S.m2.mol–1. et [Xi] en mol.m–3
Application : Une solution de chlorure de potassium de concentration 1,00.10–2 mol.L–1 sert de solution étalon pour étalonner le conductimètre. Calculer sa conductivité à 25°C
On donne, à 25°C : l K+ = 7,35.10–3 S.m2.mol–1. l Cl– = 7,63. 10–3 S.m2.mol–1.
Donner la valeur de s étalon en mS.m–1 :………………………et en mS.cm–1 :………………….
- MANIPULATION.
1) On dispose de 3 solutions d’acide acétique (ou éthanoïque) de concentrations différentes (voir tableau page 3), d’une solution d’acide méthanoïque de concentration 1,0.10–2 mol.L-1, d’une solution d’acide benzoïque de concentration 1,0.10–2 mol.L-1. Verser environ 50mL de chaque dans 5 béchers numérotés. Prévoir également un bécher de la solution étalon précédente puis un autre d’eau distillée.
2) Etalonner le conductimètre en mode compensé, pour cela :
- Rincer la cellule en la plongeant brièvement dans le bécher d’eau distillée.
- Essuyer son pourtour avec du papier.
- La plonger dans la solution étalon et relever la température à l’aide d’un thermomètre
- Mettre le conductimètre en fonctionnement, choisir le calibre 2mS.cm–1
- Avec la lame d’un tournevis, régler le bouton des températures sur la température indiquée par le thermomètre.
- Agir sur le 2ème bouton jusqu’à ce que le conductimètre affiche la conductivité de la solution étalon à 25°C c’est à dire la valeur calculée au I) : s étalon =……………mS.cm–1.
- Rincer la cellule et la plonger dans la solution À .Si la température de cette solution est bien la même que celle de la solution étalon le conductimètre affiche directement la valeur de la conductivité de la solution À à 25°C
- Noter cette valeur dans le tableau de mesures;
- Rincer la cellule et procéder de la même façon pour toutes les autres solutions. On prendra soin de changer l’eau distillée qui sert à rincer la cellule au milieu de la série de mesures (donc après 3 rinçages).
- EXPLOITATION DES RESULTATS.
- On raisonne sur la réaction d’équation-bilan générale RCOOH(aq) +H2O = RCOO–(aq) + H3O+(aq)
Ecrire l’équation pour les 3 acides concernés
- Principe des calculs pour une solution d’acide de concentration ci et de volume V :
- Compléter le tableau d’avancement
| | avancement | RCOOH(aq) + H2O = RCOO–(aq) + H3O+(aq) |
Etat initial | | ni =ci.V | | | |
Etat à la date t | | | | | |
Etat final=à l’équilibre | xéq | | | | |
- A partir de ce tableau, exprimer la concentration en ions H3O+(aq) en fonction de l’avancement à l’équilibre et de V
- Même chose pour la concentration en ions carboxylate RCOO–
- Idem pour la concentration en acide RCOOH
- Montrer que la constante à l’équilibre peut s’exprimer en fonction de la concentration en ions H3O+dans la solution finale et de la concentration ci de la solution selon la relation :

- D’autre part exprimer la conductivité s de la solution en fonction de
 ,
, , l H3O+ et l RCOO- .En déduire l’expression :
, l H3O+ et l RCOO- .En déduire l’expression : 

n peut donc à partir de la détermination expérimentale de s calculer 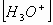 puis Qr,éq
puis Qr,éq

- Ouvrir le dossier " physique ", " document de travail " et " TS " puis copier coller sur le bureau de Windows le fichier " Quotient de réaction ". L’ouvrir afin de le compléter.
Formules utilisées dans les cases du tableau (compléter) :
G4 (à copier coller ensuite jusqu’à G8) :
H4 (à copier coller ensuite jusqu’à H8) :
I4 (à copier coller ensuite jusqu’à I8) :
J4 (à copier coller ensuite jusqu’à J8) :
K4 (à copier coller ensuite jusqu’à K8) :
4) Conclusions :
a) Comparer les valeurs de Qr,éq dans les cas À , Á et  . La valeur de Qr,éq dépend- t- elle des conditions initiales pour une réaction donnée ?
b) Comparer les valeurs de Qr,éq dans les cas À , Ã et Ä : la constante à l’équilibre de la réaction d’un acide avec l’eau dépend- t- elle de la nature de l’acide ?
c) Quelle propriété retrouve-t-on en comparant les taux d’avancement à l’équilibre pour les cas À , Á et  ?
Donc, pour une réaction donnée, le taux d’avancement à l’équilibre dépend –t- il des conditions initiales ?
d) Pour les solutions de même concentration, classer par ordre croissant les 3 acides selon le taux d’avancement. Parallèlement, comment évoluent leurs quotients de réaction à l’équilibre ?
e) Montrer, en trouvant une relation entre Qr,éq , t éq et ci ,que le taux d’avancement à l’équilibre dépend bien de la constante à l’équilibre de la réaction et des conditions initiales
Matériel
préparer matériel et solutions 2 jours avant pour que tout soit à la même température le jour du TP
Par groupe :
- conductimètre et sa cellule et le support
- 8 pots
- 1 marqueur permanent
- 2 chiffons
- pissette d’eau distillée
- thermomètre (à alcool)
- tournevis
Au bureau :
- solution de chlorure de potassium à 0.01mol/L (préparée avec une précision maximale. Pour cela en faire une fiole de 2L (ou de 5L)
- solution d’acide acétique à 0,01mol/L (50 mL/groupe soit 1L par classe)
- solution d’acide acétique à 0,005mol/L (50 mL/groupe soit 1L par classe)
- solution d’acide acétique à 0,002mol/L (50 mL/groupe soit 1L par classe)
- solution d’acide méthanoïque à 0,01mol/L (50 mL/groupe soit 1L par classe)
- solution d’acide benzoïque à 0,01mol/L : solution à mettre sous agitation magnétique pendant 24h pour dissoudre complètement l'acide benzoïque (50 mL/groupe soit 1L par classe)
- eau distillée
- chiffons
- papier Joseph
Retour à la page Terminale
![]()
![]() s en S.m–1 , l i en S.m2.mol–1. et [Xi] en mol.m–3
s en S.m–1 , l i en S.m2.mol–1. et [Xi] en mol.m–3
![]() puis Qr,éq
puis Qr,éq