C03 : ETUDE EXPÉRIMENTALE DE LA CINÉTIQUE D’UNE RÉACTION
(ceci
est un aperçu du sujet, consulter le document Word pour avoir le document
d'origine)
- OBJECTIFS
- Faire un suivi temporel d’une transformation chimique par une méthode chimique (titrage).
- Déterminer expérimentalement une vitesse de réaction et un temps de demi- réaction.
La réaction étudiée (1) est la réaction d’oxydoréduction entre les ions iodure I– et les molécules d’eau oxygénée H2O2.
- Equation bilan de cette réaction H2O2 aq + 2 I–aq + 2 H+aq ® 2H2O +I2 aq équation (1)
- PRINCIPE
Pour suivre l’évolution de cette réaction (1), on dose le diiode obtenu à différentes dates dans le milieu réactionnel, à l’aide d’une solution de thiosulfate de sodium, en présence d’empois d’amidon (ou thiodène)
L’équation de cette réaction (2) est : I2 aq + 2 S2O32–aq ® S4O62–aq + 2 I–aq équation (2)
Cette réaction possède les caractéristiques nécessaires à une réaction de titrage : elle est rapide et totale.
L’empois d’amidon prend une teinte bleue en présence de traces de diiode ; le mélange se décolore dès que le diiode disparaît. L’équivalence est donc obtenue quand la coloration de la solution passe du bleu à l’incolore.
Problème : Comment doser le diiode obtenu
sans perturber le milieu réactionnel ?® En titrant un prélèvement de volume V (ici V = 10ml)
à une date t déterminée ? ® Dès que le prélèvement est fait on y ajoute un tube à essai d’eau glacée en notant la date t à laquelle on fait cet ajout. On bloque ainsi momentanément la cinétique de la réaction étudiée en abaissant la température, ce qui laisse le temps de doser le diiode obtenu.
- MANIPULATION
1) Mode opératoire : Lire l’ensemble du protocole avant de commencer
- Remplir la burette avec la solution de thiosulfate de sodium (2Na+ + S2O32-) de concentration cth = 0,04 mol.L–1.
- Dans un bécher, placer une petite quantité d’eau glacé et un glaçon et 1mL environ d’empois d’amidon (ou thiodène).
- Dans un flacon d’un litre (au bureau), on introduit le contenu d’une fiole de 250 mL d’eau oxygénée à 0,09 mol/L auquel on ajoute 10 mL d’acide sulfurique commerciale mesurée à l’éprouvette.
- On ajoute ensuite 250 mL d’iodure de potassium à 0,2 mol.L-1 (mesurée à l’éprouvette). Déclencher AUSSITOT le chronomètre.
- Dans le bécher d’eau glacée, ajouter à l’aide de la dispensette un volume V1=10 mL du mélange contenu dans le flacon. Lire IMMEDIATEMENT le chronomètre t1 = .
- Ajouter le barreau magnétique. Doser le diode contenu dans cette solution en versant progressivement la solution de thiosulfate de sodium.
- Verser alors lentement le thiosulfate jusqu'à la décoloration (dosage à la goutte près !) et noter le volume de solution versée VthE.
- Répéter l’opération 2 fois (ne pas oublier de récupérer le barreau magnétique avec des gants puis de le mettre dans le bécher suivant).
ATTENTION, dans ce TP, l’organisation est très importante :
· Un élève prépare les 3 béchers d’eau glacé avec un glaçon et l’empois d’amidon puis verse à chacun 10 mL du mélange en lisant à chaque fois la date sur le chronomètre. Les solutions glacées peuvent alors rester en attente avant leur dosage.
· Le deuxième élève fait les dosages.
2) Tableau de résultats.
temps | 0 | t1= (~ 1’) | t2= (~ 1’30’’) | t3= (~ 2’) | t4= (~ 2’30’) | t5= (~ 3’) | t6= (~ 3’30’) | t7= (~ 4’) | t8= (~ 5’) | t9= (~ 6’) |
 (mL) (mL)
| 0 | | | | | | | | | |
Temps | t10= (~ 7’) | t11= (~ 8’) | t12= (~ 9’) | t13= (~ 10’) | t14= (~ 12’) | t15= (~ 14’) | t16= (~ 16’) | t17= (~ 18’) | t18= (~ 20’) |
 (mL) (mL)
| | | | | | | | | |
- EXPLOITATION DES RESULTATS
- Quels sont les couples mis en jeu de la réaction dont on suit le dosage (équation 1) ? Quel est l’oxydant, quel est le réducteur ? Ecrire les demi- équations d’oxydation et de réduction et retrouver l’équation proposée.
- Réaction de titrage (équation 2) : Rappeler la définition de l’équivalence. Donner la relation que l’on peut écrire à l’équivalence. En déduire la relation

 soit
soit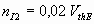 où nI2 représente la quantité de matière de diiode obtenus dans le prélèvement de 10mL à la date t et dosés.
où nI2 représente la quantité de matière de diiode obtenus dans le prélèvement de 10mL à la date t et dosés. - A l’aide de synchronie, créer les variables " temps " (en s) et "volume " (en mL) dans le tableur. Remplir le tableau de valeurs.
- Créer dans la feuille de calcul la variable nI2 puis indiquer la formule permettant de calculer cette grandeur (attention aux unités, le volume de thiosulfate est en mL, il faut le convertir dans la formule en litre).
- Paramétrer synchronie pour faire afficher le graphe nI2=f(temps) (menu paramètres, courbes, cocher fenêtre 1 pour la variable nI2, aucune fenêtre pour le temps puis onglet fenêtre, choisir " temps " pour l’abscisse puis pour l’échelle : 0 à 1300 s pour le temps et 0 à 4E-4 mol pour nI2).
- Calculer les quantités initiales de réactifs présents dans un volume de 10 mL du mélange réactionnel de l’équation 1. On négligera le volume d’acide sulfurique devant les volumes des 2 autres solutions mélangées.
- Faire un tableau d’avancement concernant 1es quantités de matière présentes dans 10 mL de ce mélange. Déterminer le réactif limitant. Justifier le choix de la fiole jaugée et de l’éprouvette graduée utilisées pour faire le mélange.
- Que faut-il changer à la courbe pour représenter l’avancement x(t) ? Calculer la vitesse de réaction à la date t @ 6 min
- La réaction étudiée est lente mais totale. Etait- elle terminée au moment de la dernière mesure ?
- Le temps de demi-réaction t 1/2 est la durée au bout de laquelle l’avancement est égal à la moitié de l’avancement final. Déterminer graphiquement t 1/2.
Matériel
Par groupe :
- Gants
- Burette graduée de 25 mL
- Agitateur magnétique
- Un bécher
- 5 pots
- petit flacon d’empois d’amidon et une pipette plastique
- petit cristallisoir
Au bureau :
- 1 L d’iodure de potassium à 0,2 mol.L-1 (dissoudre 33,22 g de KI dans 1 L)
- Solution de thiosulfate de sodium à 0,04 mol/L (1,5 L par classe )
- Acide sulfurique commerciale (flacon de 100 mL)
- 20 Glaçons pour ½ classe (40 pour la classe)
- 1 dispensette avec un flacon incolore sur un agitateur magnétique
- 2 fioles de 250 mL d’eau oxygénée à 1 V
- 1 éprouvette de 25 mL
- 1 éprouvette de 250 mL
- 1 entonnoirs plastique
Retour à la page Terminale