C01 : SUIVI TEMPOREL D’UNE REACTION CHIMIQUE PAR UNE METHODE PHYSIQUE
(ceci est un aperçu du sujet, consulter le document Word pour avoir le document d'origine)
Il est possible de suivre l’évolution d’une réaction chimique produisant un dégagement gazeux si cette réaction a lieu à volume constant , par exemple dans un ballon fermé: Il suffit de mesurer la pression P du gaz dans le ballon pendant toute la durée de l’expérience.
La transformation chimique étudiée est la réaction entre une solution d’acide éthanoïque CH3COOH(aq) et l’ion hydrogénocarbonate HCO3–(aq).
L’équation de cette réaction s’écrit : CH3COOH(aq) + HCO3–(aq) ----> CH3COO–(aq) + CO2(g) + H2O (l)
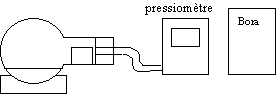
Il se dégage donc du dioxyde de carbone . La réaction a lieu dans un ballon relié à un pressiomètre lui même en liaison avec l’interface d’un ordinateur qui permet de tracer directement sur l’écran la courbe représentant la pression en fonction du temps.
Manipulation 1 :
Préparation de l’expérience :

Acquisition automatique de la pression à l’aide du boîtier Bora et du logiciel Synchronie
L’interface est le boîtier Bora qui fait correspondre une tension à chaque mesure de pression. Les mesures de tensions effectuées par le boîtier Bora se font entre la masse du boîtier (borne noire) et l’entrée EA0.
n° | Tâches |
1 | A l’aide de 2 fils de connexion, brancher la masse du montage et l’entrée EA0 aux bornes du capteur (le pressiomètre) pour réaliser la mesure de la tension à étudier. |
2 | Cliquer sur le logiciel Synchronie |
3 | Cliquer sur Paramètres du menu principal. puis l’onglet entrées |
4 | Cliquer sur le bouton 0 pour paramétrer l’entrée EA0. |
5 | Choisir le mode automatique, pour l’entrée EA0 dans la rubrique configuration matérielle. |
6 | choisir le calibre –2,5/+2,5 (c’est le calibre indiqué sur le pressiomètre) |
7 | Dans la rubrique Affichage, Changer le style en prenant des croix Vérifier que la fenêtre 1 est cochée |
8 | Choisir dans la rubrique Capteur celui qui convient, ici il s’agit du " pressiomètre SA Jeulin " |
9 | Cliquer sur l’onglet Acquis |
10 | Dans la rubrique Réglages, indiquer le nombre de points à acquérir : 100. Ne rien modifier à moyenne |
11 | Dans la rubrique Courbes, cocher ajouter |
12 | Dans la rubrique Durée, indiquer la durée totale de l'acquisition : 6 min. Synchronie modifie alors automatiquement la durée qui va s'écouler entre deux mesures (Echantillon=6x60 /100=3,6s) |
13 | Cliquer sur l'onglet Fenêtres. Echelle en X (le temps T) : minimum=0 ; maximum=6 min Echelle en Y (la pression) : minimum=0 ; maximum=2000 |
14 | Valider par Ok. |
Il faut maintenant déclencher l’acquisition automatique au moment où l’expérience commence (à t=0).Pour cela cliquer d’abord sur Exécuter dans le menu principal.
L’acquisition automatique démarre quand on clique sur acquérir signaux (raccourcis clavier F10). Il faut donc en même temps redresser le ballon pour mélanger les 2 réactifs et cliquer sur la touche F10 pour commencer l’acquisition.
BIEN MAINTENIR LE BOUCHON SUR LE BALLON PUIS AGITER REGULIEREMENT
Si l’acquisition a bien lieu, il apparaît " acquisition en cours " en bas de l’écran ainsi que le nombre de mesures déjà effectuées puis les points apparaissent sur l’écran. On peut arrêter l’acquisition avant la réalisation des 100 mesures ,dès que la pression se stabilise, en cliquant sur ESC ou Echap
Manipulation 2 :
Objectif :Etudier l’influence de la concentration d’un réactif sur l’évolution de la réaction.
On se propose de recommencer l’expérience en changeant la concentration de l’acide éthanoïque.
Préparer le même dispositif en versant 50 mL d’acide éthanoïque de concentration 2 fois moins grande c’=0,5 mol.L–1
Noter la valeur de la pression initiale : Pi=… …………..
Paramétrage de synchronie :Le précédent paramétrage reste validé .
Déclenchement de l‘acquisition :cliquer sur exécuter puis acquérir signaux. Une fenêtre s’ouvre et affiche :" conserver les acquisitions précédentes ? ". C’est le clic sur OK qui donne le départ : redresser le ballon en même temps.
Vérifier que l’acquisition est bien en cours. La courbes précédente n’apparaît pas à l’écran. Il faut attendre la fin de l’acquisition pour voir apparaître les deux courbes. La précédente est en trait continu, la dernière est tracée avec des croix. Interrompre l’acquisition quand on constate que la valeur de la pression s’est stabilisée.
Bien repérer les courbes puis changer le style (double cliquer sur l’ordonnées " pression(khPa) " pour obtenir les 2 en trait fin continu avant d’imprimer. Pour imprimer, cliquer sur l’icône imprimer, puis choisir l’orientation de l‘impression en mode paysage puis imprimer.
A la fin de la manipulation :
Exploitations des résultats expérimentaux.
Données : Masse molaire (en g.mol–1) : M(Na)=23, M(C)=12, M(O)=16 et M(H)=1 ; R=8,31 U.S.I ; T(K)=T(°C)+273 ;
MATERIEL
Expérience assistée par ordinateur
Par classe de 16 groupes prévoir 2,5l de solution d’acide éthanoïque à 1mol/L et 2,5L solution d’acide éthanoïque à 0,5 mol/L (la valeur de la concentration des solutions n’a pas à être ultra précise)
Par groupe :
Au bureau :